圖(1)個股筆記:6492 生華科(圖片素材取自個股官網)
更新日期:2025 年 03 月 24 日
免責聲明
請先參閱首頁的免責聲明,再繼續閱讀本文。
生華生物科技:聚焦創新抗癌新藥,邁向國際市場的生技新星
生華生物科技股份有限公司(Senhwa Biosciences, Inc.,股票代號:6492.TW)於 2012 年 11 月 16 日在新北市新店區成立,專注於開發具備新穎作用機制的小分子抗癌新藥及特殊原料藥。公司以「創新帶來美好生活」為企業理念,致力於透過技術創新,研發有效對抗癌症並改善人類健康之藥物,並以成為 First-in-class 新藥開發公司為目標。
公司沿革與發展歷程
奠基與轉型 (2012-2017)
生華科創立初期,即確立以小分子抗癌新藥開發為核心方向,並採取臨床開發為主、基礎研究為輔的策略,期望在競爭激烈的生技產業中快速取得進展。
資本市場與國際拓展 (2017-至今)
2017 年 4 月 24 日,生華科於證券櫃檯買賣中心 (TPEx) 成功上櫃,為公司發展注入資本動能。上櫃後,生華科加速研發進程,並積極尋求國際合作,拓展全球市場。
經營團隊與專業背景
生華科經營團隊匯集多位具備國際藥廠經驗之資深專家,為公司發展提供堅實後盾:
- 馮玉蓮博士:具備近 30 年國際藥廠新藥研發經驗,曾任嬌生集團楊森藥廠全球總裁、諾華癌症事業部執行長等要職,並擔任科技部特聘顧問及行政院生技產業策略諮議委員會 (BTC) 委員,其於臨床生物標誌、診斷策略及精準醫療領域具備深厚專業。
- 陳敏鋑醫師:現任美國 MultiCare Regional Cancer Center 資深醫師及華盛頓大學醫學中心 (UW MED) 臨床教師,具備豐富臨床腫瘤學經驗。
- 醫務長黃品諺醫師:畢業於臺北醫學大學醫學系,並取得東吳大學法律碩士,兼具醫學專業與法律背景。
核心產品與技術平台
生華科聚焦於小分子抗癌新藥開發,目前主要產品線包含兩大核心藥物:
CX-5461 (Pidnarulex):RNA 聚合酶 I 抑制劑
CX-5461 為 First-in-class 的 RNA 聚合酶 I 抑制劑,作用機制獨特,能選擇性活化抑癌蛋白 p53,針對癌細胞進行精準打擊,同時降低對健康細胞之影響。CX-5461 優先鎖定血液性癌症及 BRCA2/PALB2 基因缺損之實體腫瘤,如乳癌、卵巢癌、胰臟癌及攝護腺癌等。
圖(2)CX-5461(資料來源:生華科公司網站)
CX-4945 (Silmitasertib):蛋白激酶 CK2 抑制劑
CX-4945 為市場首見之 蛋白激酶 CK2 抑制劑,透過抑制 CK2 蛋白激酶,干擾癌細胞 DNA 修復機制,促使癌細胞凋亡。CX-4945 主要開發用於膽管癌、髓母細胞瘤、神經母細胞瘤等罕見癌症,並同步評估於社區型肺炎之應用潛力。

圖(3)CX-4945(資料來源:生華科公司網站)

圖(4)開發進程(資料來源:生華科公司網站)
產品應用領域與市場潛力
生華科產品線鎖定癌症治療及抗病毒感染兩大領域,具備廣闊市場潛力:
腫瘤治療領域
- 血液性癌症與實體腫瘤:CX-5461 針對血液性癌症及多種實體腫瘤,特別是具 BRCA2/PALB2 基因缺損之癌症,符合精準醫療趨勢。
- 罕見癌症:CX-4945 鎖定膽管癌、髓母細胞瘤、神經母細胞瘤等罕見癌症,已取得美國 FDA 孤兒藥資格認定,具備市場獨賣期及法規優勢。
抗病毒感染領域
- 社區型肺炎 (CAP):CX-4945 於抗病毒感染領域展現潛力,正進行針對新冠/流感引發社區型肺炎之臨床試驗。社區型肺炎為全球重要健康負擔,市場規模龐大。
營收結構與財務概況
截至 2024 年,生華科資本額達新台幣 8.97 億元,市值約新台幣 38.68 億元。目前公司營收主要來自於技術諮詢服務,新藥產品尚處於研發階段,未有商業化銷售收入。然隨著 CX-5461 及 CX-4945 等新藥研發進程推進,未來營收結構可望轉型,逐步提升產品營收佔比。
市場布局與競爭態勢
全球市場布局
生華科以全球市場為目標,積極拓展國際合作,主要銷售區域涵蓋:
- 美國:全球最大藥品市場,為生華科重點目標市場,已於美國展開多項臨床試驗,並與當地機構建立合作關係。
- 歐洲:歐洲市場對新藥需求持續成長,生華科亦積極尋求於歐洲市場之發展機會。
- 亞洲:亞洲市場抗癌藥物需求日益增加,生華科亦積極拓展亞洲業務。
主要競爭對手
生華科於抗癌藥物市場面臨來自國內外藥廠之競爭,主要競爭對手包含:
- 大型製藥公司:如 Novartis、Pfizer、Bristol-Myers Squibb、Roche、Eli Lilly 等國際藥廠,具備雄厚研發資源與市場通路優勢。
- 專注特定癌症領域之生技公司:於特定癌症治療領域具備技術積累與產品線之生技公司。
- 新興生技公司:專注罕見疾病或特定癌症之新興生技公司,具備研發彈性與創新能力。
競爭優勢分析
生華科於競爭激烈的抗癌藥物市場中,具備以下競爭優勢:
- 創新研發能力:專注 First-in-class 新藥開發,如 CX-5461 具備獨特 p53 活化機制,CX-4945 為市場首見 CK2 抑制劑。
- 策略合作夥伴關係:與美國國家癌症研究所 (NCI)、Beat Childhood Cancer Research Consortium (BCCRC) 等國際權威機構建立合作,提升研發實力與國際能見度。
- 孤兒藥資格認定:CX-4945 已獲美國 FDA 孤兒藥資格認定,享有市場獨賣期等法規優勢。
近期重大進展與未來展望
CX-5461 獲 NCI 五年期贊助
2024 年 9 月,生華科宣布 CX-5461 獲美國國家癌症研究所 (NCI) 五年期贊助,將主導 CX-5461 於晚期實體腫瘤之臨床試驗,並探索與免疫療法等合併用藥之潛力。此項贊助不僅提升 CX-5461 研發能量,亦帶動股價顯著上漲。
CX-4945 獲罕見兒科疾病認定
2024 年 10 月,CX-4945 獲美國 FDA 罕見兒科疾病認定,加速其於復發及難治型兒童實體腫瘤之開發進程。CX-4945 亦獲得神經母細胞瘤孤兒藥資格認定,展現其於兒童癌症治療領域之潛力。
積極拓展免疫療法市場
生華科於 2024 年法人說明會中表示,將持續發展免疫療法市場,並加速罕病新藥 CX-4945 開發,預計加快上市腳步。公司預估免疫療法市場至 2036 年將超過 1.58 兆美元,年複合成長率達 15.2%,市場前景可期。
重點整理
生華生物科技股份有限公司專注於創新抗癌新藥研發,具備獨特藥物作用機制與國際合作優勢。公司核心產品 CX-5461 及 CX-4945 於臨床試驗階段屢傳捷報,並獲得美國 NCI 及 FDA 等機構支持與認可。隨著新藥研發進程加速及市場拓展,生華科未來發展潛力可期,有望於全球生技醫療市場佔據重要地位。
參考資料說明
公司官方文件
- 生華生物科技股份有限公司公司基本資料
- 生華生物科技股份有限公司法人說明會簡報 (2024.12.26)
- 生華生物科技股份有限公司企業社會責任報告書
產業研究報告
- 元大投顧產業分析報告 (2024.12)
- 富邦證券產業研究報告 (2024.12)
- 凱基證券投資分析報告 (2025.01)
新聞報導
- 鉅亨網產業分析專文 (2024.12.27)
- 經濟日報專題報導 (2024.12.26)
- 工商時報產業分析 (2024.11.11)
- GeneOnline 基因線上專題報導 (2024.09.18)
- MoneyDJ 理財網新聞 (2024.09.12)
- 中央社新聞 (2024.11.06)
- Yahoo! 股市新聞 (2024.09.21)
永續發展文件
- 科學基礎減量目標倡議 (SBTi) 審核報告 (2024.12)
註: 本文內容主要依據上述 2024 年第三、四季及 2025 年初之公開資訊進行分析與整理。所有財務數據及市場分析均來自公開可得之官方文件、研究報告及新聞報導。
參考資料來源
資料來源:生華科公司網站、法說資料、券商研究報告、鉅亨網、Moneydj、各大報新聞。
公司網址:https://www.senhwabio.com/
法說會中文檔案連結:https://mopsov.twse.com.tw/nas/STR/649220241225M001.pdf
法說會影音連結:https://youtu.be/dwV7lxU8IPM
基本概況
股價:42.25
預估本益比:nan
預估殖利率:0.0%
預估現金股利:0.0元
報表更新進度:☑ 月報 ☑ 季報
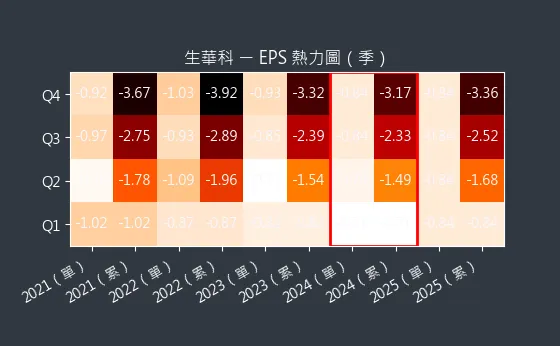
圖(5)6492 生華科 EPS 熱力圖
股價走勢
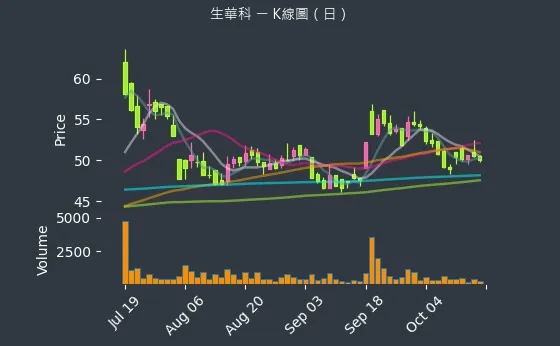
圖(6)6492 生華科 K線圖(日)
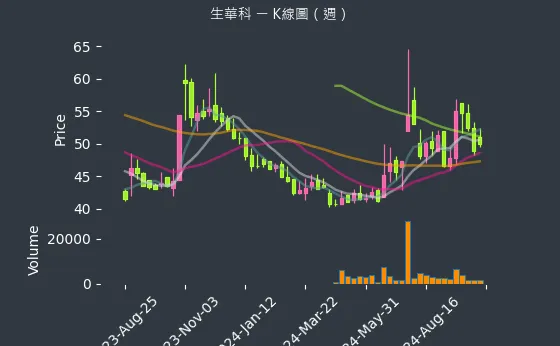
圖(7)6492 生華科 K線圖(週)
圖(8)6492 生華科 K線圖(月)
日報表
圖(9)6492 生華科 法人籌碼
週報表
圖(10)6492 生華科 大戶籌碼
月報表
圖(11)6492 生華科 內部人持股
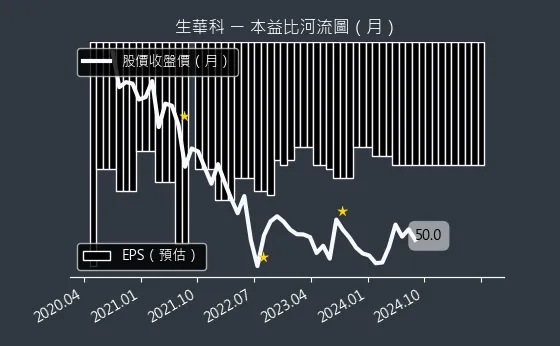
圖(12)6492 生華科 本益比河流圖
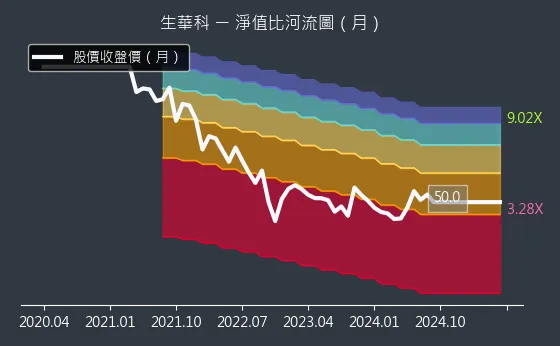
圖(13)6492 生華科 淨值比河流圖
新聞筆記
達103.34萬元
象
lmitasertib(CX-4945)開發,預計
加快上市腳步 Note right of 2024.12.26: →免疫療法市場預計到 36 年 將超過1.58兆美
元,年複合成長率達15.2% Note right of 2024.12.26: →CX-5461在美國國家癌症研究所主導的5年計畫
中,將探索多種生物標記及擴大適應症開發 Note right of 2024.12.26: →Silmitasertib(CX-4945)已獲
得膽管癌、膽道癌等多項孤兒藥認定,並專注於孤兒藥市
場 Note right of 2024.12.26: →生華科專注於新藥臨床驗證及國際合作,積極推動產品
線及創新療法的發展
-4945)在美國賓州州立健康兒童醫院成功收治首位
復發/難治型兒童及青少年實體腫瘤患者,標誌著臨床試
驗的開始 Note right of 2024.11.06: →該試驗由Beat Childhood Cance
r Research Consortium與賓州州
立大學附設兒童醫院合作,計畫由Dr. Gisell
e Saulnier Sholler主導,並將利用
全美超過55間醫院的資源進行 Note right of 2024.11.06: →Silmitasertib是一種CK2抑制劑,臨
床前研究顯示其對多種難治型兒童腫瘤具有顯著療效,生
華科期待其在治療神經母細胞瘤等疾病中的應用 Note right of 2024.11.06: →生華科計畫申請孤兒藥及罕見兒科疾病認定,以爭取優
先審核憑證(PRV),加速新藥上市進程 Note right of 2024.11.06: →生華科宣布其新藥Silmitasertib(CX
-4945)已在美國賓州州立健康兒童醫院收治首位患
者,展開針對復發及難治型兒童腫瘤的二期臨床試驗 Note right of 2024.11.06: →該公司計劃申請孤兒藥及罕見兒科疾病認定,以獲得優
先審核憑證(PRV),加速新藥上市進程 Note right of 2024.11.06: →臨床試驗由全美知名的兒癌聯盟Beat Child
hood Cancer Research Cons
ortium執行,旨在滿足對新療法的迫切需求 Note right of 2024.11.06: →Silmitasertib作為CK2抑制劑,能有
效抑制腫瘤細胞增殖,臨床前研究顯示其對多種難治型兒
童腫瘤有顯著療效 Note right of 2024.11.06: →除了神經母細胞瘤,試驗還包括尤因肉瘤和骨肉瘤,這
些病症在兒科中預後不良且醫療需求未滿足
的藥物研發經驗能加速公司發展 Note right of 2024.11.02: →馮玉蓮擁有近30年國際大廠新藥研發經驗,曾在多家
知名藥廠擔任要職,推動精準醫療的發展 Note right of 2024.11.02: →她在生物科技及醫療研發領域的專業知識將有助於生華
科在國際市場的商業化進程
,股價攻克月線、季線,成交量暴增,有望進一步上漲
瘤的孤兒藥認定資格,顯示其開發潛力 Note right of 2024.10.26: →此藥物若成為首個核准用於該適應症的藥物,將享有7
年的市場獨賣保護期 Note right of 2024.10.26: →CX-4945已獲得多項癌症適應症的孤兒藥資格,
包括膽管癌和髓母細胞瘤 Note right of 2024.10.26: →生華科與賓州州立大學及Beat Childhoo
d Cancer Research Consort
ium合作進行二期臨床試驗,專注於難治型兒童腫瘤 Note right of 2024.10.26: →神經母細胞瘤是最常見的兒童惡性實體腫瘤之一,早期
診斷率低,存活率僅約30% Note right of 2024.10.26: →生華科宣布其新藥Silmitasertib(CX
-4945)針對神經母細胞瘤獲得美國FDA的孤兒藥
(ODD)認證,這將提供七年的市場獨賣期保障 Note right of 2024.10.26: →該藥物已獲得罕見兒科疾病認定(RPDD),並計劃
與美國賓州州立大學及Beat Childhood
Cancer Research Consortiu
m合作進行臨床試驗
45)獲得FDA的孤兒藥認定資格,針對神經母細胞瘤
的治療展現潛力 Note right of 2024.10.25: →該藥物上市後可享有7年的獨賣期,進一步促進其市場
競爭力
支持,並獲得FDA核准進行臨床試驗
,推動股價漲幅超過15% Note right of 2024.09.21: ↑CX-5461獲美國NCI贊助,CX-4945再
度獲FDA罕見兒科疾病認定,助力未來上市潛力
所(NCI)贊助,支持五年抗癌計畫實驗用藥 Note right of 2024.09.18: →將針對晚期實體腫瘤患者進行藥效動力學試驗,並已向
美國FDA提出IND申請 Note right of 2024.09.18: →未來可能進行合併用藥人體試驗,包括免疫療法和抗體
藥物複合物等 Note right of 2024.09.18: →受此利多影響,生華科股價一早漲停至52.3元,投
資前景受到市場高度關注
得美國NCI五年贊助,激勵股價漲停至52.3元 Note right of 2024.09.12: →NCI將主導臨床試驗,探索該藥物在晚期實體腫瘤患
者的藥效,並可能結合免疫療法等多種療法
1)Phase 1b臨床試驗結果,顯示對多種癌症有
治療潛力 Note right of 2024.09.09: →該數據已於 24 年 歐洲腫瘤醫學學會ESMO大
會以海報形式發表,並在官網上線
45)獲美國FDA核准進行一/二期人體臨床實驗,用
於治療復發/難治型兒童及青少年實體腫瘤 Note right of 2024.08.07: →此臨床試驗由全美55間大學及兒童醫院合作,將有助
於提升新藥的研究資源與專業性 Note right of 2024.08.07: →生華科計畫申請孤兒藥及罕見兒科疾病認定,爭取優先
審核憑證(PRV),以加速新藥上市 Note right of 2024.08.07: →實驗經費由Four Diamonds Found
ation贊助,生華科提供新藥,計畫收治59位兒童
,包括神經母細胞瘤、尤因氏肉瘤和骨肉瘤等病患
00%,前7月累積營收58.3萬元,年增0.00% Note right of 2024.08.04: →生華科將於 9M24 13至 2024.08.1
7 歐洲腫瘤醫學學會發表新藥Pidnarulex的
試驗摘要,該藥治療多種腫瘤擴增療效
用,進行復發/難治型兒童腫瘤的臨床實驗 Note right of 3Q24: ↑該實驗將合併使用化療藥物,並已向FDA提出IND
申請,生華科計劃申請孤兒藥及罕見兒科疾病認定 Note right of 3Q24: →實驗經費由Four Diamonds基金會贊助,
生華科提供CX-4945作為臨床用藥,初步規劃收治
59名患者 Note right of 3Q24: ↑生華科的新藥Pidnarulex(CX-5461
)將於 24 年 歐洲腫瘤醫學學會(ESMO)年會
發表,治療BRCA2或PALB2基因缺損腫瘤的試驗
摘要獲選 Note right of 3Q24: →ESMO大會為全球三大癌症醫學會之一,此次發表摘
要由加拿大Princess Margaret Ca
ncer Centre撰寫,預計日前上線 Note right of 3Q24: →Pidnarulex(CX-5461)主要應用於
乳癌、卵巢癌、胰臟癌等實體腫瘤,第一期臨床試驗將於
24 年啟動,針對末期患者進行
DA)提交候選新藥,正在第二期人體臨床試驗IND申
請利多 Note right of 4Q23: ↑CX-4945上一階段在美國執行兩項抗新冠病毒人
體臨床,用於輕症或中重症治療皆展現其改善臨床症狀、
加速患者恢復健康的正面成果 Note right of 4Q23: ↑瞄準泛病毒抗感染商機,生華科日前公告,向美FDA
提交Silmitasertib(CX-4945)新
藥二期人體臨床試驗IND申請 Note right of 4Q23: ↑華科總經理黃金鼎先前在法說會表示,後疫情因免疫負
債(免疫力變差)引發各種病毒和細菌感染升溫,生華科
23 年起將轉向以癌症、抗感染雙引擎布局
,符合本次求償受理條件之投資人,儘速填妥相關表格、
檢附證明文件及簽具相關書件 Note right of 3Q23: ↑治療晚期基底細胞癌一期臨床 將進行數據分析 Note right of 3Q23: ↑皮膚癌一期臨床完成 末期患者多活一年病況穩定
4945)在台灣申請進行新的二期人體臨床試驗,已獲
台灣衛福部食藥署通知核准執行並將盡速啟動收案
深度分析
季報表
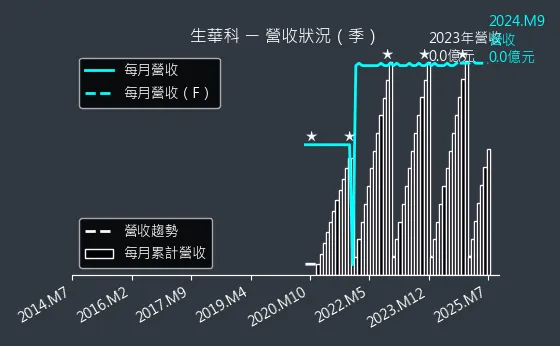
圖(14)6492 生華科 營收狀況
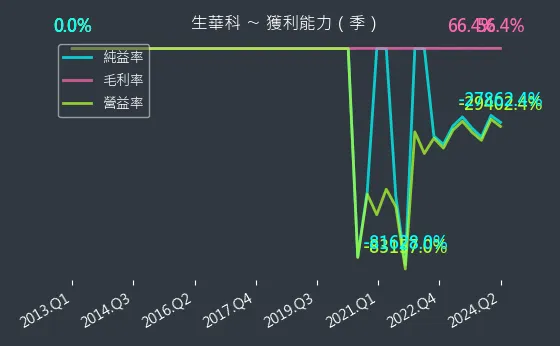
圖(15)6492 生華科 獲利能力
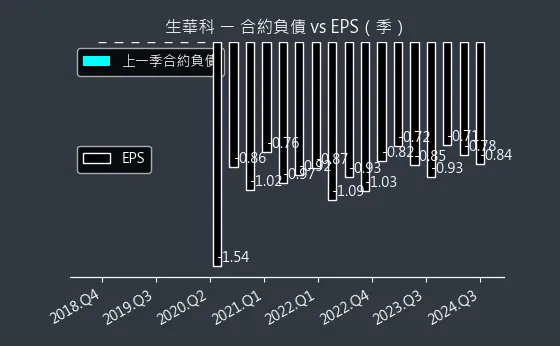
圖(16)6492 生華科 合約負債
圖(17)6492 生華科 存貨與平均售貨天數
圖(18)6492 生華科 存貨與存貨營收比
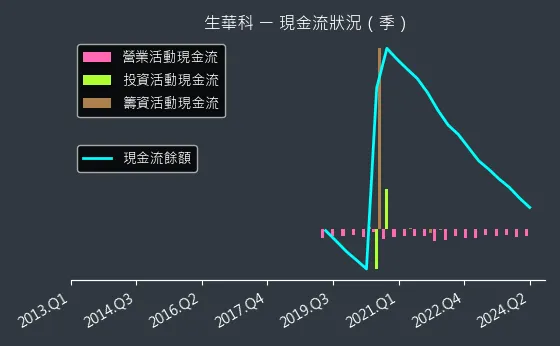
圖(19)6492 生華科 現金流狀況
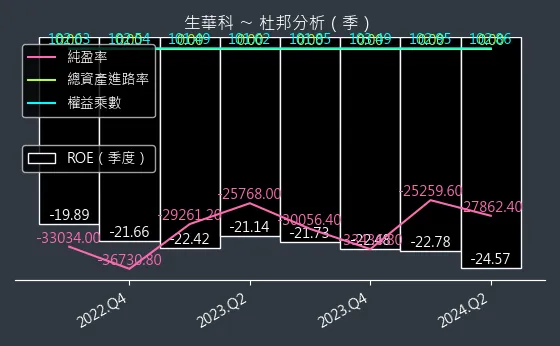
圖(20)6492 生華科 杜邦分析
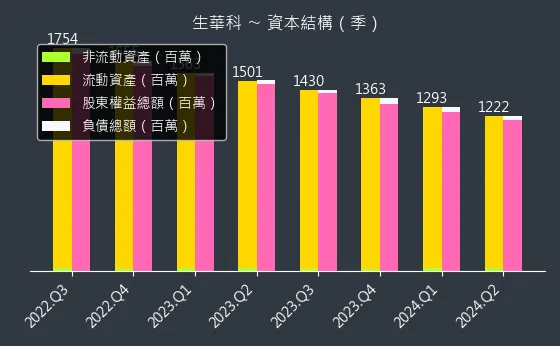
圖(21)6492 生華科 資本結構
年報表
圖(22)6492 生華科 股利政策
