圖(1)個股筆記:6576 逸達(圖片素材取自個股官網)
更新日期:2025 年 03 月 25 日
免責聲明
請先參閱首頁的免責聲明,再繼續閱讀本文。
逸達生技:創新藥物研發的領航者
逸達生物科技股份有限公司(Foresee Pharmaceuticals Co., Ltd.,股票代號:6576)成立於 2007 年,是一家專注於創新藥物研發的生技醫藥公司。公司總部設在台灣台北,並在美國加州設立研發中心,形成跨國研發網絡。現階段公司已發展成為台灣生技產業的重要代表企業之一。
營業項目與主要業務
逸達生技的業務主軸圍繞在兩大核心技術平台:
- 穩定注射劑型平台(SIF):此平台技術讓長效型針劑能應用於慢性疾病治療,目前已成功開發出 CAMCEVI 等商業化產品。
- 新化學成分(NCE)研發:專注於開發創新小分子藥物,針對未被滿足的醫療需求提供解決方案。
主要產品與營收結構
CAMCEVI(主力產品)
- 用途:治療晚期前列腺癌的長效針劑
- 特色:採用六個月劑型設計,相較傳統每月或每三個月注射方式更便利
- 市占率:在美國市場穩定維持 15% 左右
- 銷售表現:2024 年第一季創下單季銷售 5,651 支新高
- 保險覆蓋:Medicare 覆蓋率 96%,商業保險覆蓋率 91%
研發中產品線
FP-045(ALDH2 活化劑)
– 階段:進入二期臨床試驗
– 用途:治療間質性肺病引起的肺高壓
– 目標:預計招募 126 位受試者
FP-020(Linvemastat,MMP-12 抑制劑)
– 進展:一期臨床試驗結果良好
– 計畫:2025 年啟動氣喘及發炎性腸道疾病的二期臨床試驗
營運地區與市場布局
美國市場
- CAMCEVI 自 2022 年上市,獲得醫療專業人員正面評價
- 新患者與轉換患者各約占銷售量的一半
- 2024 年底前將申請三個月劑型新藥許可
歐洲市場
- 2022 年 5 月獲得歐盟 EMA 新藥上市許可
- 適用範圍:27 個歐盟成員國及其他地區
- 2024 年 11 月獲英國 MHRA 上市許可
- 首批產品已從法國製劑廠出貨至德國
亞洲市場
- 中國:預計 2024 年底或 2025 年初申請藥證
- 台灣:作為研發及營運總部
- 產品銷售:透過授權合作模式拓展市場
競爭優勢
技術平台優勢
– 獨家 SIF 技術解決高活性藥物配方問題
– 專利保護期至 2039 年
– 持續開發新世代製劑技術
商業策略優勢
– 與國際大廠策略聯盟
– 多元化的授權合作模式
– 全球化的市場布局
近期發展與財務表現
2024 年前 11 個月,逸達合併營收達 4.04 億元,年增 143%,首次突破 4 億元。公司完成 13.68 億元現金增資,將投入營運與研發,支持 2025 年多項臨床試驗。
未來展望
逸達生技規劃在多個領域持續擴張:
產品線擴展
– CAMCEVI 三個月劑型預計 2025 年獲批
– 開發 FP-014 前列腺癌新藥
– 推進氣喘及腸道疾病新藥研發
市場開拓
– 深化美國市場滲透
– 拓展歐洲市場銷售網絡
– 布局中國等新興市場
研發投入
– 持續開發新型製劑技術
– 擴大臨床試驗規模
– 探索新適應症機會
市場發展前景
產業市場規模
前列腺癌治療市場規模龐大,全球市場預估 2030 年達 249 億美元。以中國市場為例,每年約有 35.7 萬個乳癌新病例,其中 HR+/HER2- 型最為普遍,為 CAMCEVI 提供廣大的市場成長空間。
在肺部疾病治療領域,2021 年主要國家的 PH-ILD 病患約有 16.6 萬名,市場價值達 12.63 億美元。FP-045 正朝向成為首個 PH-ILD 口服藥物的目標邁進。同時,FP-020(Linvemastat)在氣喘及發炎性腸道疾病治療領域的市場潛力也達數十億美元。
研發進程規劃
逸達生技規劃在 2025 年執行多項重要臨床試驗:
- 啟動 FP-014 前列腺癌三期臨床試驗
- 開展 FP-020 用於氣喘及腸道疾病的二期臨床試驗
- 向 EMA 申請 CAMCEVI 三個月劑型的歐盟藥證
在大中華區域,公司計劃於 2026 年上半年完成 FP-001 的中國三期臨床試驗。此試驗將招募約 200 位停經前乳癌患者,採用開放標籤、隨機、平行對照組設計,比較每 6 個月注射一次 FP-001 與每 12 週注射柳菩林的療效。
營運策略布局
逸達透過策略性授權合作,持續拓展全球市場。在歐洲,公司已於 2019 年將 CAMCEVI 授權給 Accord Healthcare 負責銷售。在中國市場,與長春金賽建立合作關係,由合作夥伴負擔臨床試驗費用,未來產品商業化後逸達可獲得銷售里程金及分潤。
技術發展方向
公司持續深化核心技術優勢:
穩定注射劑型平台(SIF)
– 改良現有配方技術
– 開發新型長效針劑
– 擴大適應症範圍
新化學成分(NCE)研發
– 開發創新分子藥物
– 探索新治療領域
– 優化藥物特性
投資與發展計畫
逸達於 2024 年 12 月完成 13.68 億元現金增資,資金用途包括:
- 支援 2025 年多項臨床試驗
- 償還營運借款
- 投資美國子公司
- 補充營運資金
風險與挑戰
公司目前面臨的主要挑戰包括:
研發成本高昂
– 臨床試驗費用持續增加
– 新藥開發週期長
– 研發人才成本上升
市場競爭加劇
– 國際大廠進入競爭
– 替代性治療方案增加
– 價格競爭壓力提升
原物料價格波動
– 供應鏈不穩定性增加
– 生產成本控制難度提高
– 全球通膨影響
因應策略
為克服上述挑戰,逸達採取多項策略:
研發效率提升
– 優化臨床試驗設計
– 加強專案管理能力
– 建立國際研發網絡
市場競爭力強化
– 深化產品差異化優勢
– 擴大市場准入範圍
– 提升品牌知名度
營運效率優化
– 強化供應鏈管理
– 提升生產效率
– 建立成本控制機制
總結來說,逸達生技憑藉其創新的藥物研發能力和獨特的技術平台,正逐步在全球生技醫藥產業站穩腳步。未來幾年,隨著新藥研發進程的推進和市場布局的深化,公司有望實現更大的發展。然而,在邁向成功的道路上,維持研發動能、把握市場機會及管控營運風險,將是公司持續成長的關鍵。
參考資料來源
資料來源:逸達公司網站、法說資料、券商研究報告、鉅亨網、Moneydj、各大報新聞。
公司網址:https://www.foreseepharma.com/
法說會中文檔案連結:https://mopsov.twse.com.tw/nas/STR/657620240703M001.pdf
法說會影音連結:http://irconference.twse.com.tw/6576_31_20240703_ch.mp4
基本概況
股價:83.5
預估本益比:0.85
預估殖利率:0.0%
預估現金股利:0.0元
報表更新進度:☑ 月報 ☑ 季報
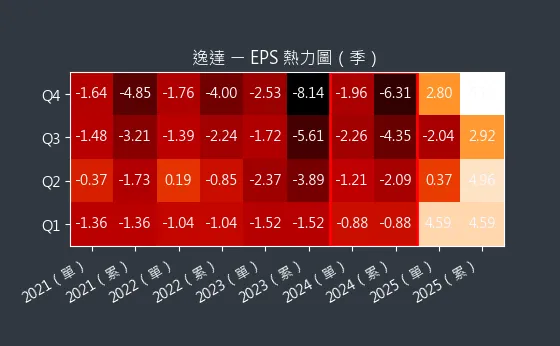
圖(2)6576 逸達 EPS 熱力圖
股價走勢
圖(3)6576 逸達 K線圖(日)
圖(4)6576 逸達 K線圖(週)
圖(5)6576 逸達 K線圖(月)
日報表
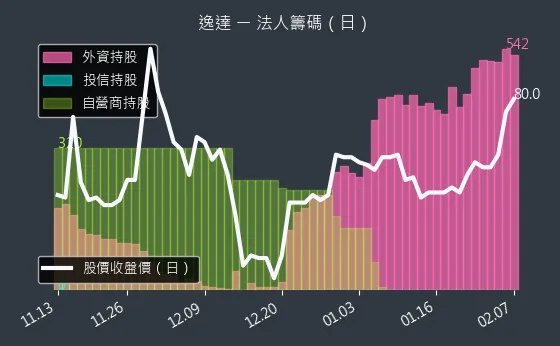
圖(6)6576 逸達 法人籌碼
週報表
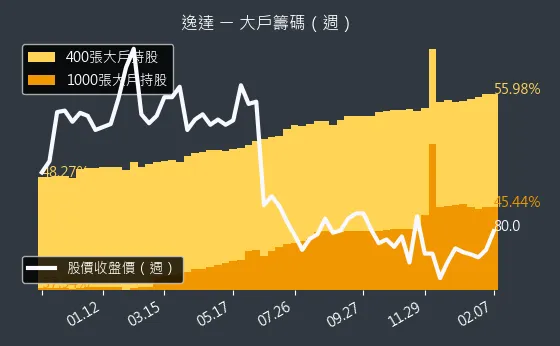
圖(7)6576 逸達 大戶籌碼
月報表
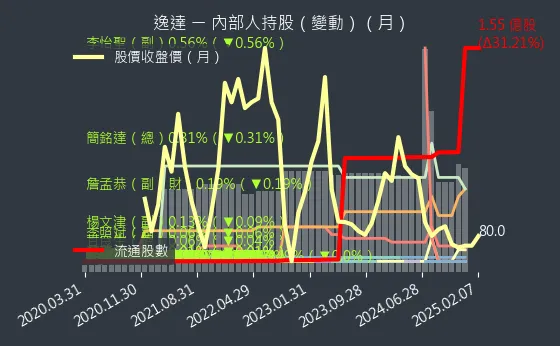
圖(8)6576 逸達 內部人持股
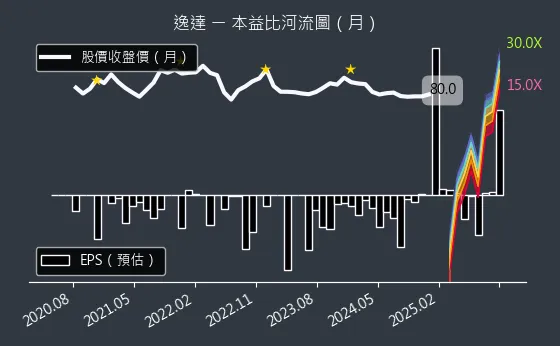
圖(9)6576 逸達 本益比河流圖
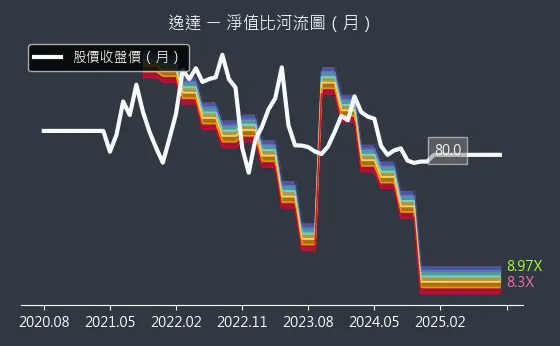
圖(10)6576 逸達 淨值比河流圖
新聞筆記
%,年增148%,創同期新高 Note right of 2025.03.11: ↑2M25 營收包含亮丙瑞林中國藥證申請里程金收入
4920萬元,及供貨CAMCEVI六個月劑型予美國
經銷商之銷貨收入1416萬元,與美國終端市場銷售分
潤737萬元 Note right of 2025.03.11: ↑授權夥伴Accord遞交CAMCEVI 3個月劑
型歐洲上市許可申請 Note right of 2025.03.11: →逸達CAMCEVI 3個月劑型美國NDA於202
4.10提出申請,目標日為2025.08.29 Note right of 2025.03.11: →CAMCEVI六個月劑型 2M25 美國終端市場
銷售量1845支 Note right of 2025.03.11: →Accord將在加拿大等國銷售CAMCEVI六個
月劑型 Note right of 2025.03.11: →長春金賽已向中國NMPA遞交CAMCEVI六個月
劑型藥證申請
示不定期出貨 Note right of 2025.02.08: ↑CAMCEVI六個月劑型 1M25 美國終端銷量
創同期新高 Note right of 2025.02.08: →預計 1Q25 向EMA提出CAMCEVI三個月
劑型歐盟藥證申請 Note right of 2025.02.08: →授權夥伴金賽,前列腺癌新藥完成中國上市許可申請
國藥證審查目標日為 2025.08.29 Note right of 2025.01.15: →逸達將於 1Q25 向EMA申請CAMCEVI三
個月劑型歐盟藥證 Note right of 2025.01.15: ↑若美國順利取證,逸達將啟動產品上市銷售,擴大市佔
率 Note right of 2025.01.15: ↑逸達 12M24 合併營收月增56%,25 年合
併營收創新高,年增115% Note right of 2025.01.15: →CAMCEVI六個月劑型 12M25 美國終端銷
售量月減8%,但仍年增54% Note right of 2025.01.15: ↑CAMCEVI六個月劑型 4Q25 終端銷售量創
新高,達6,269支 Note right of 2025.01.15: →授權夥伴將在德國、加拿大銷售CAMCEVI六個月
劑型 Note right of 2025.01.15: →長春金賽藥業將向大陸NMPA遞交CAMCEVI六
個月劑型藥證申請 Note right of 2025.01.15: →美國三個月劑型市場規模是六個月劑型的兩倍以上 Note right of 2025.01.15: ↑逸達期待 8M25 順利取得CAMCEVI三個月
劑型美國藥證,並於美國上市
藥證審查目標日為 2025.08.29 Note right of 2025.01.14: →此新藥為根據三期臨床試驗結果,申請之前列腺癌緩解
治療的緩釋注射劑 Note right of 2025.01.14: →試驗收案144位晚期前列腺癌患者,每三個月施打一
劑,具療效、安全性及耐受性 Note right of 2025.01.14: ↑逸達期待與FDA合作,於 8M25 順利取得CA
MCEVI三個月劑型藥證 Note right of 2025.01.14: →逸達目標於美國市場上市銷售此新藥 Note right of 2025.01.14: →美國三個月劑型市場規模是六個月劑型的兩倍以上 Note right of 2025.01.14: →三個月劑型上市,加上現有六個月劑型,將提供完整產
品系列 Note right of 2025.01.14: →新藥上市將為逸達帶來銷售權利金及里程金收入,並帶
動六個月劑型銷量 Note right of 2025.01.14: →逸達生技收到美國FDA發送之第74天函 Note right of 2025.01.14: →CAMCEVI三個月劑型美國藥證審查完成目標日為
2025.08.29 Note right of 2025.01.14: ↑逸達期望 8M25 順利取得CAMCEVI三個月
劑型藥證 Note right of 2025.01.14: ↑新劑型上市將為逸達帶來新的銷售權利金與里程金收入 Note right of 2025.01.14: ↑新劑型可望進一步帶動既有六個月劑型之銷售量與市占
率 Note right of 2025.01.14: →三個月劑型藥證申請依據成功的三期臨床試驗結果 Note right of 2025.01.14: →臨床試驗證明CAMCEVI三個月劑型具療效、安全
性與耐受性 Note right of 2025.01.14: →試驗數據顯示,97.9%的受試者達到主要療效指標
509萬元,月增56% Note right of 2025.01.09: ↑逸達 24 年 合併營收約4.19億元,年增11
5%,創歷史新高 Note right of 2025.01.09: ↑12M25 營收包含CAMCEVI六個月劑型美國
銷售分潤、德國上市供貨及三個月劑型藥證申請勞務收入 Note right of 2025.01.09: →12M25 美國經銷商無銷貨收入,因無供貨 Note right of 2025.01.09: ↑CAMCEVI六個月劑型 12M25 美國終端銷
售量1,990支,較前一年同期成長54% Note right of 2025.01.09: ↑CAMCEVI六個月劑型 4Q25 終端銷售量6
,269支,創單季新高 Note right of 2025.01.09: ↑逸達已於 12M24 向美國FDA遞交CAMCE
VI三個月劑型藥證,進入實質審查 Note right of 2025.01.09: ↑逸達預計2025 2H25 取得CAMCEVI三
個月劑型美國藥證 Note right of 2025.01.09: ↑逸達預計 1Q25 向EMA提出CAMCEVI三
個月劑型歐盟藥證申請 Note right of 2025.01.09: ↑CAMCEVI六個月劑型美國市占率增長趨勢不變 Note right of 2025.01.09: ↑CAMCEVI相關營收可望於 2H25 取得三個
月劑型美國藥證里程金助攻 Note right of 2025.01.09: ↑CAMCEVI六個月劑型將於 25 年在德國、加
拿大等國銷售 Note right of 2025.01.09: ↑長春金賽藥業將向中國NMPA遞交CAMCEVI六
個月劑型藥證申請
劑型之美國新藥申請(NDA)已進入實質審查 Note right of 2024.12.29: ↑逸達於美國時間2024.10.29完成向FDA遞
交CAMCEVI 3個月劑型之NDA申請 Note right of 2024.12.29: →依據FDA通知函,送件後60天內未收到資料不完全
之通知,將進入實質審查 Note right of 2024.12.29: →截至美國時間2024.12.27,逸達未收到資料
不完全通知,因此申請案進入實質審查 Note right of 2024.12.29: →根據PDUFA法案,審查目標日期將依FDA第74
天函所示,核准時間取決於FDA Note right of 2024.12.29: →全球癌症資料庫統計,前列腺癌為全球男性第二大常見
癌症,22 年 全球男性新例約14.2%罹患前列腺
癌 Note right of 2024.12.29: →22 年 全球前列腺癌藥物市場約164.6億美元
,預估 32 年 達到365.4億美元,年增長率為
8.3% Note right of 2024.12.29: →21 年 全球leuprolide市場價值約24
.55億美元,預估 27 年 達32.64億美元,
年增長率約4.86%
製劑廠出貨,運送至德國指定儲存倉庫,準備上市 Note right of 2024.12.18: ↑CAMCEVI於 22 年 獲歐盟EMA新藥上市
許可,並適用於所有27個歐盟成員國及其他地區,英國
上市許可於 24 年 獲准 Note right of 2024.12.18: ↑CAMCEVI在歐盟及英國的銷售由授權夥伴Acc
ord Healthcare主導,逸達依授權合約獲
得相關收入,專利保護至 39 年 Note right of 2024.12.18: ↓逸達 24 年 前 11M24 營收達4.03億
元,年增143%,但前三季每股淨損4.35元 Note right of 2024.12.18: ↑逸達已向美國FDA遞交CAMCEVI三個月劑型的
新藥查驗登記,預計 25 年取得上市許可 Note right of 2024.12.18: ↑逸達大陸授權夥伴計劃於年底或 25 年初向大陸N
MPA遞交CAMCEVI藥證申請,三期臨床試驗持續
進行中 Note right of 2024.12.18: ↑逸達宣布首批前列腺癌新劑型新藥 CAMCEVI
42 毫克 6 個月針劑已出貨,將運送至德國儲存倉
庫 Note right of 2024.12.18: ↑CAMCEVI 42 毫克於 5M22 獲歐盟E
MA新藥上市許可,適用於治療荷爾蒙依賴型晚期前列腺
癌等 Note right of 2024.12.18: →逸達將CAMCEVI授權給Accord Heal
thcare,產品在歐盟及英國上市,由Accord
主導銷售,專利保護至 39 年 Note right of 2024.12.18: →CAMCEVI在歐盟的上市許可涵蓋27個成員國及
冰島、挪威、列支敦士登,英國許可於 11M24 獲
批 Note right of 2024.12.18: ↑逸達的前列腺癌新劑型新藥CAMCEVI 42毫克
六個月針劑已出貨,首波將於德國上市,並計劃在其他歐
盟國家、加拿大、英國等地上市 Note right of 2024.12.18: →CAMCEVI 42毫克於 5M22 獲歐盟EM
A新藥上市許可,用於治療荷爾蒙依賴型晚期前列腺癌,
並適用於27個歐盟成員國等地 Note right of 2024.12.18: →逸達於 19 年 將CAMCEVI授權給Acco
rd Healthcare,後者負責歐洲市場的銷售
與規劃 Note right of 2024.12.18: ↑逸達已於 10M24 底向美國FDA提交CAMC
EVI三個月劑型的美國藥證申請,預計 25 年 獲
批並於 26 年 上市 Note right of 2024.12.18: →逸達計劃 1Q25 向EMA申請CAMCEVI三
個月劑型的歐盟藥證
年增143%,首次突破4億元大關 Note right of 2024.12.09: →逸達計畫 25 年完成FP-020新藥國際授權,
並針對免疫纖維化疾病開發新藥 Note right of 2024.12.09: →逸達已向美國FDA遞交CAMCEVI三個月劑型的
新藥申請,預期 25 年 獲得藥證 Note right of 2024.12.09: →CAMCEVI六個月劑型在美國市場 11M24
銷售量成長3%,年增30%,有望進一步推升業績 Note right of 2024.12.09: →FP-020一期臨床顯示良好的安全性與藥物動力學
特性,將進行二期臨床試驗
於營運與研發,支援 25 年開展的多項臨床試驗 Note right of 2024.12.05: →25 年將開展FP-014前列腺癌三期臨床試驗、
FP-020氣喘及腸道疾病治療二期臨床試驗等,並持
續推進新藥研發進程
釋注射劑獲得英國藥品監管機構MHRA的上市許可,將
用于治療成人晚期前列腺癌 Note right of 2024.11.28: ↑CAMCEVI 42毫克利用獨家緩釋針劑平台技術
研發,解決了過去高活性柳菩林針劑需要人工混合的問題
,提升使用便捷性
美國藥證,並於 26 年 上市銷售,將帶來新一波的
收入增長
VI的藥證,預計 25 年獲得上市許可,26 年
開始銷售 Note right of 2024.11.01: ↑該新劑型新藥的申請基於三期臨床試驗結果,144位
晚期前列腺癌患者中有97.9%達到主要療效指標
腺癌治療的三個月緩釋劑型 Note right of 2024.10.30: ↑此新藥的研發旨在改善患者的治療效果及生活品質,並
提供更長效的用藥方案
深度分析
季報表
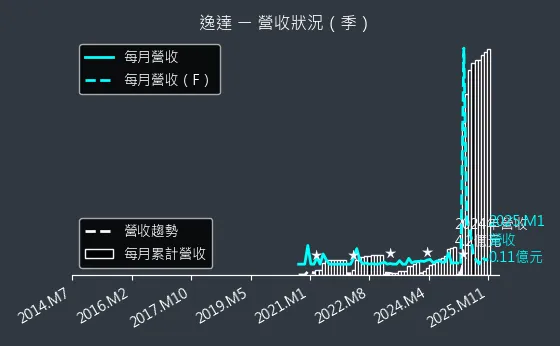
圖(11)6576 逸達 營收狀況
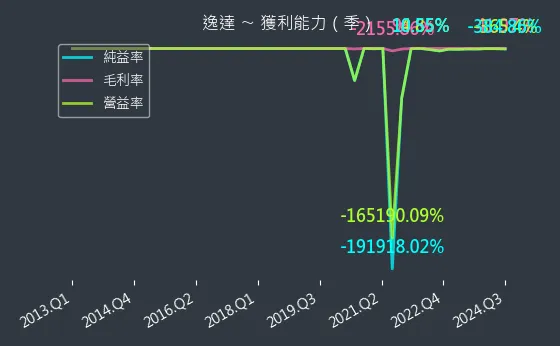
圖(12)6576 逸達 獲利能力
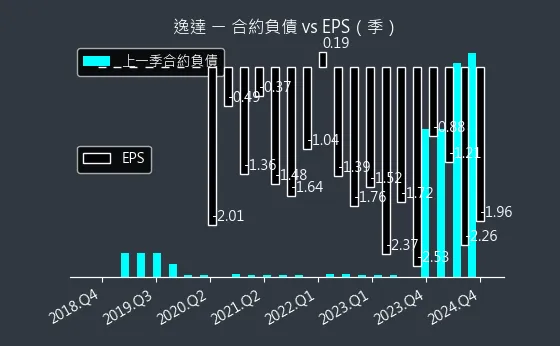
圖(13)6576 逸達 合約負債
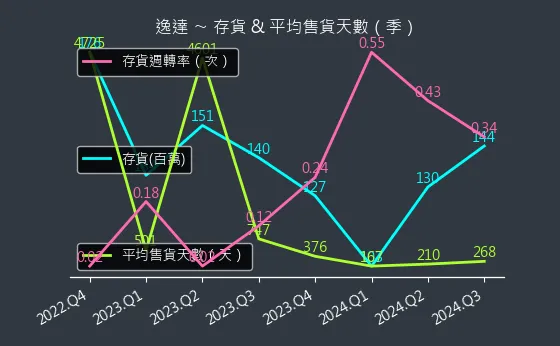
圖(14)6576 逸達 存貨與平均售貨天數
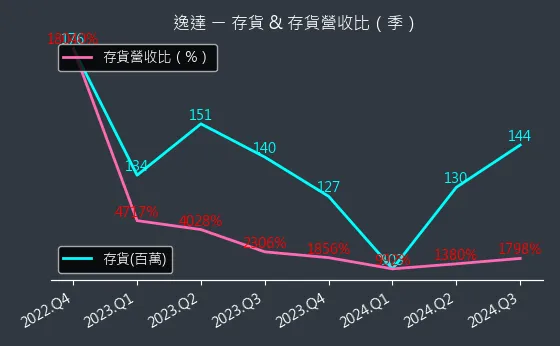
圖(15)6576 逸達 存貨與存貨營收比
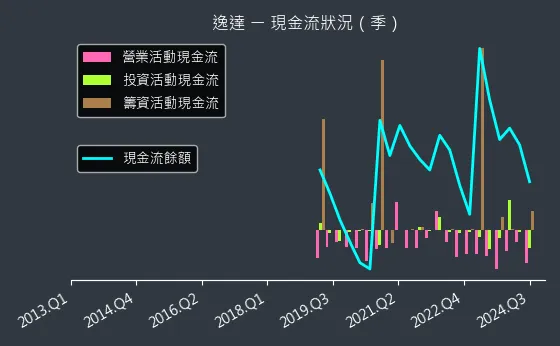
圖(16)6576 逸達 現金流狀況
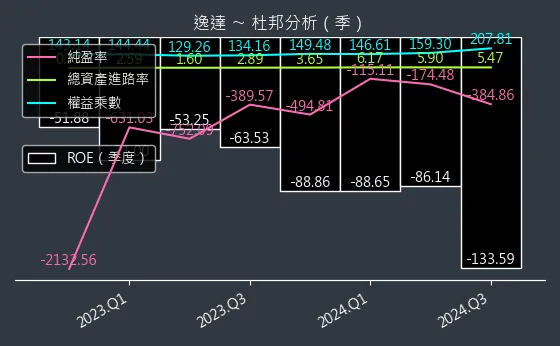
圖(17)6576 逸達 杜邦分析
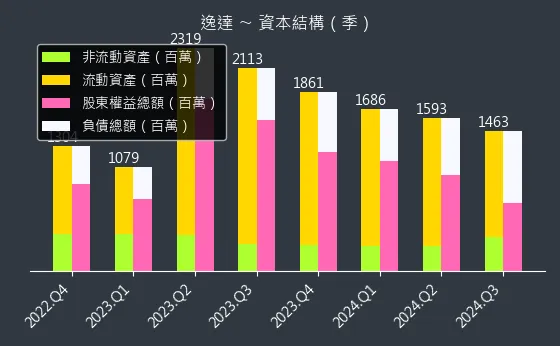
圖(18)6576 逸達 資本結構
年報表
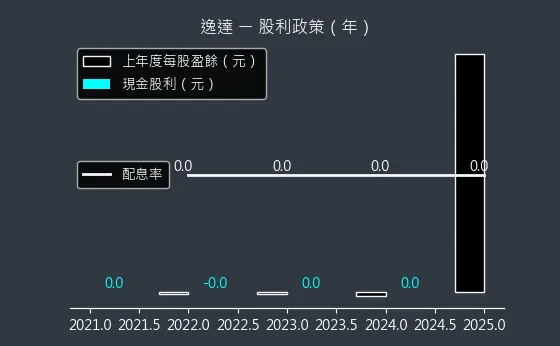
圖(19)6576 逸達 股利政策
